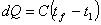
Il calore è una forma di energia legata al movimento degli atomi o delle molecole all'interno della materia. L'unità di misura che lo definisce è il joule, ma può anche essere misurato con lacaloria (ossia l'equivalente del calore necessario ad 1g d'acqua per aumentare di un grado la sua temperatura, precisamente da 14,5°C a 15,5°C) che equivale a 4,186J.
Quando un oggetto aumenta la sua temperatura di ΔT assorbendo una quantità di calore ΔQ, tra queste due grandezze si può individuare una costante di proporzionalità detta capacità termica:
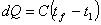
Se si considera la capacità termica nell'unità di massa come, ad esempio, la mole,
si parlerà allora di calore specifico molare, ossia la proprietà di una sostanza
che indica il rapporto tra la variazione di calore e la variazione di temperatura
in una trasformazione.
Se si considera una quantità di sostanza m omogenea, il calore specifico è:
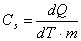
Partendo dal Primo principio della termodinamica:
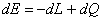
si possono individuare alcuni casi particolari in cui il calore specifico è costante.
In una isocora, ad esempio, il sistema non compie lavoro, per cui il calore specifico
molare a volume costante (per una mole di gas perfetto monoatomico) risulta:
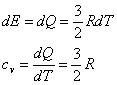
In una isobara, invece, la quantità di lavoro può essere ottenuta utilizzando l'equazione di Clapeyron, per cui il calore specifico molare a pressione costante (per una mole di gas perfetto monoatomico) risulta:
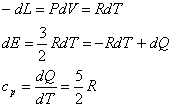
Per misurare il calore specifico di una sostanza si può utilizzare un calorimetro.
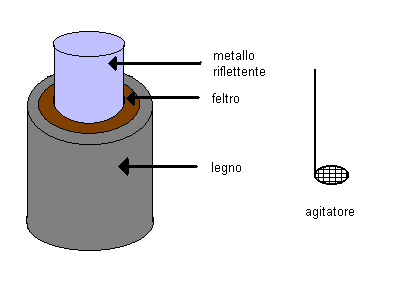
Lo strumento di cui è stato fatto uso durante gli esperimenti è
costituito da un vaso Dewar , da un supporto in legno con la parete interna
feltrata, da un coperchio in materia sintetica e da un agitatore.
Il vaso Dewar ha una capacità di 300cm3 ed una superficie
argentata riflettente per ridurre al minimo le perdite di calore (poichè
bisogna tenere in conto che l'energia, oltre a trasmettersi per conduzione,
si tramette anche per irraggiamento, con onde elettromagnetiche).
Il coperchio è traforato: ha un buco per l'agitatore ed uno per il termometro,
necessario per la rilevazione delle temperature.
Prima di procedere con un esperimento, però, è neccessario considerare
che lo strumento può non essere perfettamente isolante, influendo così negli scambi
di energia assorbendo calore.
Per semplicità si può utilizzare dell'acqua per cercare la massa equivalente
del calorimetro.
Si versi una massa d'acqua ad una temperatura ambiente tf nel vaso Dewar
e successivamente si aggiunga un'ugual massa d'acqua a temperatura maggiore tc.
A questo punto si può rilevare la temperatura di equilibrio te
e calcolare la massa equivalente me:
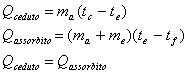
Quindi:
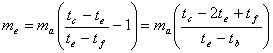
Per ricaveare il calore specifico di una sostanza ignota basta immergere una massa mc a temperatura tc all'iterno di una quantità d'acqua ma a temperatura ta. Dopo aver rilevato la temperatura di equilibrio si ottiene:
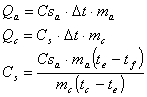
Che, tenendo conto del calore assorbito dal calorimetro e considerando il calore specifico dell'acqua pari ad 1 (anche se tale valore è preciso solo per l'acqua distillata a 14,5°), diventa:
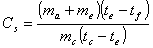
La prima operazione consiste nel versare all'interno del calorimetro una massa d'acqua pari a 100cm3 ed attendere qualche minuto finchè essa non raggiunge la stessa temperatura tfdel continitore.
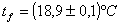
Successivamente si versa un'ugual massa d'acqua calda (riscaldata in un pentolino) a temperatura tc nota
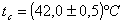
e si chiude il più velocemente possibile il tappo del calorimetro.
I contenitori di cui disponevo, però, avevano capacità di 50cm3, quindi ho dovuto ripetere l'operazione due volte, con conseguenze sulla precisione della misura, che è stata raddoppiata:
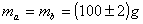
Per rendere la temperatura di equilibrio più omogenea all'interno della sostanza
è oppurtuno mescolare l'acqua con l'apposito agitatore.
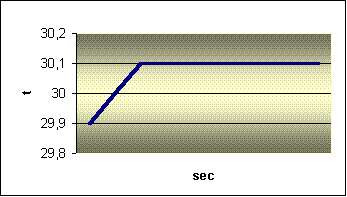
Per misurare te ho annotato i valori crescenti
della temperatura con un intervallo di 20 secondi per tre minuti:
| Temperatura (°C) | Frequenza |
|---|---|
| 29,9 | 1 |
| 30,0 | 1 |
| 30,1 | 8 |
Le mie aspettative iniziali erano di osservare il raggiungimento di una certa temperatura e, subito dopo, un calo della stessa; però dall'analisi del grafico risulta una stabile temperatura di eqilibrio pari a:
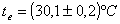
Per la misurazione delle temperature sono stati utilizzati due termometri
diversi, poichè quello con sensibilità al decimo di grado Celsius non aveva una scala
abbastanza alta per rilevare temperature troppo calde. Per queste ultime, quindi,
mi sono servita di un termometro con sensibilità minore (di mezzo grado)
L'incertezza sui valori della massa dell'acqua, invece, è pari ad un grammo.
Ora che sono in possesso di tutti i dati necessari posso calcolare la massa equivalente in acqua del calorimetro attraverso la formula:
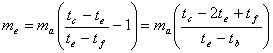
E si ottiene:
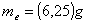
L'incertezza assoluta sarà data dalla formula
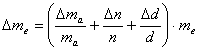
in cui n è il numeratore della frazione e d è il denominatore.
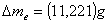
La misura dell'equivalente in acqua risulta:
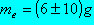
Come è facile intuire, la misura non ha una precisione sufficiente, poichè
l'incertezza assoluta non solo è alta, ma addirittura supera il valore stesso della misura.
Per questo motivo nella seconda parte dell'esperimento farò uso della
massa equivalente del calorimetro fornita dal costruttore dello strumeto:
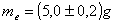
Con questa scheda si possono effettuare prove utilizzando diversi valori di massa e temperatura per ricavare il corrispondente valore di equivalente in acqua del calorimetro.
Per effettuare la seconda parte dell'esperimento mi sono servita degli stessi strumenti già descritti in precedenza, pertanto le incertezze assolute sulle misure saranno le stesse.
Verso nel calorimetro una massa d'acqua fredda di 150cm3
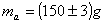
e ne rilevo la temperatura tf:
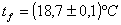
Successivamente immergo una massa campione di materiale ignoto precedentenmente riscaldata in acqua calda su un fornello a gas a temperatura tc nota
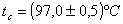
e chiudo il più velocemente possibile il tappo del calorimetro.
Per rendere la temperatura di equilibrio più omogenea all'interno della sostanza
è oppurtuno mescolare l'acqua con l'apposito agitatore.
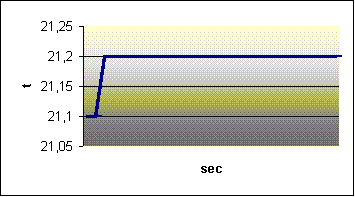
Per misurare te ho annotato i valori crescenti
della temperatura con un intervallo di 20 secondi per 10 minuti:
| Temperatura (°C) | Frequenza |
|---|---|
| 21,1 | 2 |
| 21,2 | 29 |
Anche in questo caso si manifesta il raggiungimento di una stabile temperatura di equilibrio, contro le mie aspettative iniziali:
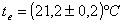
Ora che sono in possesso di tutti i dati necessari posso calcolare il calore specifico della massa campione attraverso la formula:
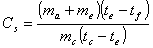
In cui mc è la massa del campione:
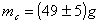
E si ottiene:
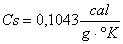
L'incertezza assoluta sarà data dalla formula
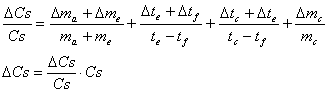
in cui n è il numeratore della frazione e d è il denominatore.
La misura del calore specifico risulta:
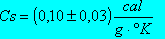
I dati delle temperature utilizzati sono in gradi Celsius, ma ssi sarebbe raggiunto lo stesso risultato anche con i Kelvin poichè se si considerano solo le differenze tra i vari valori, le due unità corrispondono.
Per trasformare la misura in unità S.I. è sufficiente moltiplicareper 4186, poichè 1cal = 4,186Joule e 1g = 10-3Kg:
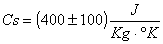
Il calore specifico ottenuto corrisponde, entro gli errori, a quello del ferro, quindi si può supporre che la massa sia costituita di questo materiale.
Con questa scheda si possono effettuare prove utilizzando diversi valori di masse e temperature per ricavare il calore specifico di una sostanza.
Le sostanze utilizzate durante l'esperimento sono state considerate omogenee e, per quanto
riguarda l'acqua, le si è attribuito un calore specifico pari ad uno anche se non era distillata
e a 14,5°C.
Inoltre è stato trascurato il ruolo dell'aria rimasta nel calorimtro durante le trasformazioni
poichè la sua influenza sarebbe sata, molto probabilmente, al di sotto della sensibilità degli
strumenti a nostra disposizione.
Il risultato riguardante l'equivalente in acqua del calorimetro non si può considerare abbastanza soddisfacente poichè l'incertezza relativa sulla misura è quasi del 200%; per questo nella seconda parte dell'esperienza mi sono dovuta avvalere della massa equivalente fornita dal costruttore per non compromettere anche l'incertezza sul calore specifico.
La causa principale di un così elevato Δme si può ricondurre
alla scarsa precisione di parte della strumentazione disponibile, soprattutto per quanto
riguarda i contenitori per l'acqua che, avendo capacità di soli 50cc, non hanno permesso un
unico travaso del liquido.
Anche durante la rilevazione delle temperature più alte è stato necessario l'utilizzo
di un termometro con sensibilità minore e, dopo aver notato (nella prima parte
dell'esperimento) che l'incertezza finale non era soddisfacente, si è deciso di
portare l'acqua del pentolino (e quindi la massa campione) ad una temperatura più
alta, per diminuire così l'incertezza relativa.
Di notevole importanza sono stati anche gli accorgimenti e le precauzioni operati
durante lo svolgimento dell'esperienza. Nel il travasare l'acqua, ad esempio,
ho fatto attenzione ai menischi che si formavano alla supeficie ed alle goccioline
che potevano rimanere attaccate alla parete del contenitore. Quando ho versato l'acqua calda,
poi, (o anche quando ho immerso la massa campione) mi sono preoccupata di richiudere il tappo
del calorimetro il più in fretta possibile al fine di evitare dispersioni di calore.
Attraverso l'elaborazione matematica, poi, si nota che utilizzando due uguali masse d'acqua per il calcolo dell'equivalente del calorimetro, è possibile operare una semplificazione (raccogliendo a fattor comune ma), snellendo, quindi, anche il calcolo dell'incertezza assoluta.
Un risultato che si può ritenere soddisfacente è quello della temperatura di equilibrio;
questa, infatti, in entrambi i casi, si è stabilizzata su un valore preciso smentendo
l'ipotesi teorica da me avanzata prima dell'esperienza:
prevedevo, infatti, un andamento curvilinio, caratterizzato da un iniziale aumento (che si
è verificato), da un picco e da una lenta diminuzione della temperatura.
Nella pratica, però, il "picco" corrisponde alla temperatura di equilibrio e si mantiene
per diversi minuti.
Questo mostra l'efficienza del calorimtro nel ridurre la dispersione di calore ad un
valore così piccolo da essere considerato trascurabile (soprattutto perchè al di sotto
della sensibilità degli strumenti).