Svolgimento dell'esperienza
Il metodo più elementare per valutare il numero di Avogadro è contare le molecole effettivamente presenti in una sostanza cercando di ottenere uno strato di tale sostanza tanto sottile da poterlo ragionevolmente supporre unimolecolare (formato cioè da un solo strato di molecole molecola).
Esistono vari metodi per ottenere uno strato così sottile di una materia. Quello più facilmente intuibile è la riduzione in fogli di un metallo molto malleabile. Tuttavia usando questo metodo non abbiamo assicurazioni che il foglio sia realmente di spessore unimolecolare, e in ogni caso ottenere un foglio così sottile è molto difficile.
Un metodo decisamente più sicuro, anche se meno intuitivo, è versare qualche goccia di olio su un liquido come l'acqua. Poichè le molecole dell'olio sono molto più grandi di quelle dell'acqua, l'olio rimane sulla superficie e tende a spandersi per tutto il recipiente finchè la macchia d'olio creatasi non ha uno spessore presumibilmente unimolecolare oppure finchè essa non viene fermata dai bordi del recipiente.
Conoscendo il volume della goccia di olio depositata e la superficie della macchia creatasi sulla superficie dell'acqua, si può fare una valutazione dello spessore della molecola, che sarà uguale al rapporto tra il volume della goccia e la sua superficie.
A questo punto, per valutare ulteriore informazioni sulle molecole è necessario fare un'ipotesi sulla loro forma. Si potrebbe ad esempio ipotizzare che la molecola abbia forma cubica, sferica o cilindrica.
Se si conosce la forma di una singola molecola (e quindi si è in grado di valutare il suo volume), si può calcolare il numero di molecole presenti nella goccia (come rapporto tra il volume della goccia e il volume di una sola molecola) e anche la massa di una singola molecola (come prodotto tra la densità dell'olio e il volume di una molecola).
Conoscendo la massa di 1 mole dell'olio e quella di una molecola dello stesso, si può dare una valutazione approssimativa del numero di Avogadro come rapporto tra le due grandezze.
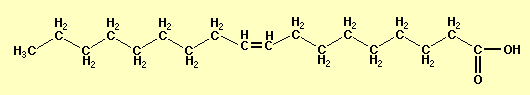
L'olio che abbiamo utilizzato nella nostra esperienza è l'acido oleico (il principale componente dell'olio d'oliva) che ha formula chimica C18H34O2.

L'acido oleico ha una densità minore rispetto all'acqua (ρacido oleico = (8,73 ± 0,01) · 10-1 g/cm 3) e quindi non si mescola con essa. Inoltre, l'acido oleico ha una bassa tensione superficiale e si spande molto facilmente.
L'acido oleico ha anche un'altra proprietà: le sue molecole sono molto lunghe e composte di due parti; una parte apolare e idrofoba (cioè che è respinta dall'acqua) e un'altra parte polare e idrofila (cioè che è attirata dall'acqua). Questa proprietà è causata dal fatto che le parti idrofile possono formare legami a idrogeno con l'acqua, mentre quelle idrofobe non possono e vengono respinte elettricamente. Per questo motivo, le molecole di acido oleico a disporsi verticalmente sull'acqua. E' importante considerare questo fattore nel valutare il numero di Avogadro usando quest'acido.
Eccedendo nella quantità di acido oleico utilizzato per creare la macchia, avremmo rischiato di riempire tutta la
superficie dell'acqua, rendendo impossibile determinare se la macchia fosse effettivamente unimolecolare oppure no.
Per evitare questo pericolo, abbiamo utilizzato, anzichè l'acido oleico puro, una sua soluzione 1/10000 con esano, un solvente volatile.
Per rendere evidente la macchia di acido oleico (trasparente) sull'acqua (anch'essa trasparente) abbiamo utilizzato
polvere di licopodio sparsa sulla superficie dell'acqua prima dello svolgimento dell'esperienza.
Il licopodio è stato poi "spinto" via dalla goccia di soluzione di acido oleico in esano, rendendo molto più evidente la forma della macchia
formatasi.
| Vai alla pagina precedente | Vai alla pagina successiva |