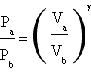
Nicolas Clément (1779-1841) e suo genero, C.B. Desormes (1777-1862), erano due imprenditori francesi che si avvicinarono allo studio empirico della chimica per tutelare i propri interessi economici. In particolare il loro contributo si concentrò nello studio dei gas e del calore.
L'esperienza di Clément Desormes permette di misurare γ di un gas. Essendo γ il rapporto tra il calore specifico a pressione costante Cp e il calore specifico a volume costante Cv di un gas, l'esperienza di Clément e Desormes permette sia una verifica sperimentale della teoria dei gas perfetti sia, una volta che essa sia stata accettata come valida, una classificazione di qualsiasi gas tra quelli mono, bi o poliatomici a seconda del valore di γ ottenuto. Svolgendo ad esempio l'esperienza utilizzandol'aria,considerabile come un gas biatomico, si otterrebbe un valore confacente alle aspettative teoriche se esso si avvicinasse a 1.4.
Poiché Cp e Cv non sono facilmente misurabili i due francesi ritennero più utile sfruttare una diversa equazione in cui comparisse γ in modo tale da esprimere tale rapporto in funzione di grandezze più facilmente quantificabili. Tale equazione era rappresentata dall'equazione di Poisson per le adiabatiche, P1V1γ=P2V2γ, così decisero di dividere la loro esperienza in due momenti successivi: prima avrebbero sottoposto il gas ad una compressione adiabatica portandolo dallo stato iniziale A allo stato intermedio B, poi lo avrebbero lasciato raffreddare in maniera isocora fino allo stato finale C la cui temperatura fosse uguale a quella di partenza. (n.b. la temperatura in B é necessariamente maggiore della temperatura in A poiché una compressione adiabatica produce sempre un riscaldamento. Nelle adiabatiche infatti ΔU=1.5RΔT=-L ed essendo -L=PΔV sempre positivo in caso di compressione anche la variazione di temperatura deve esserlo quindi la temperatura finale deve essere maggiore di quella iniziale).
Dall'equazione di Poisson si ottiene
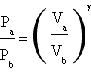
In cui il volume può essere espresso grazie all'equazione di stato dei gas perfetti come

Da cui si ottiene
 .
.
Completando poi l'esperienza con il raffreddamento isocoro per la legge di Gay-Lussac si ha
![]()
in cui Tc=Ta. Il rapporto tra Tb e Ta risulta pertanto uguale a quello tra Pb e Pc e permette quindi di concludere
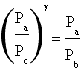 .
.
Facendo il ln di entrambi i membri si risolve l'equazione ottenendo
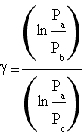 .
.
Per comodità si può fare in modo che a Pb corrisponda la pressione atmosferica mentre Pa e Pc siano due depressioni (misurate con un manometro a liquido di densità ρ) esprimibili attraverso il principio di Stevin come
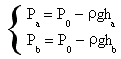 .
.
Ricordando che per piccoli valori di x, ln(1-x)≈-x il numeratore della frazione con cui é espresso γ risulta
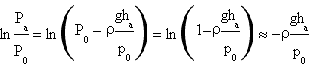
Il denominatore invece risulta
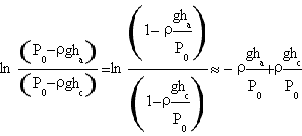 .
.
In definitiva l'espressione di γ é
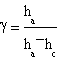
Per sfruttare l'espressione di gamma ottenuta da Clément e Desormes ci siamo serviti di un contenitore di vetro chiuso da un tappo di gomma attraversato da due tubi. Uno di questi due tubi era collegato ad un manometro a liquido (nel nostro caso alcool), l'altro ad una chiave che metteva in collegamento il contenitore dapprima con un tubo di venturi poi con l'esterno.
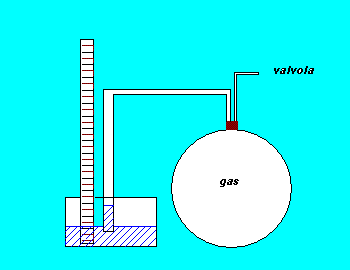
Nella prima fase dell'esperienza abbiamo creato una depressione all'interno del contenitore, originariamente a pressione atmosferica, sfruttando il principio del tubo di Venturi. Ottenuta la depressione abbiamo isolato il sistema chiudendo la chiavetta e, dopo aver atteso che il gas all'interno del contenitore avesse dissipato il calore assorbito dal precedente processo e si fosse stabilizzato a temperatura ambiente (stadio A), abbiamo misurato la pressione interna grazie al manometro.
Per dar luogo alla reazione adiabatica che porta allo stato B, abbiamo staccato il tubo di Venturi dallo strumento e abbiamo aperto la chiave permettendo all'aria dell'esterno di entrare per riportare al pressione del contenitore a pressione atmosferica. Appena finito il fruscio originato dall'entrata dell'aria abbiamo isolato nuovamente il sistema chiudendo la chiavetta. Siamo giunti così allo stadio B, a pressione atmosferica e temperatura maggiore di quella di partenza (si ricordi che una compressione adiabatica produce riscaldamento).
Il passaggio allo stato C é stato realizzato attendendo che tra il sistema e l'ambiente si ristabilisse l'equilibrio termico attraverso un processo definibile isocoro. Lo stato C, risultato del raffreddamento del gas all'interno del contenitore, risultava così nuovamente a temperatura ambiente (ossia alla stessa temperatura di A). Alla fine del raffreddamento all'interno del contenitore si era creata una depressione poiché per i processi isocori vale la legge di Gay-Lussac che afferma la diretta proporzionalità tra P e T. Misurando, sempre grazie al manometro, il valore della pressione in C, abbiamo concluso le rilevazioni necessarie allo svolgimento dei nostri calcoli.
Il passaggio dallo stato A allo stato B può essere considerato adiabatico poiché avviene talmente velocemente da non permettere uno scambio significativo di calore tra il sistema e l'ambiente; il passaggio dallo stato B allo stato C può invece essere considerato isocoro poiché, mantenendo chiusa la chiavetta, il volume occupato dal gas rimane pressoché costante dato che la sua dilatazione all'interno del manometro può essere considerata trascurabile (ovviamente ciò é tanto più vero quanto più é capiente il contenitore).
Considerate le numerose operazioni da compiere e la necessità di acquisire una minima manualità nell'eseguirle abbiamo ripetuto l'esperienza più volte ottenendo risultati sempre più aderenti alle nostre aspettative.
Le prove migliori hanno fornito questi dati:
| ha= (33.0±0.1) cm | ha= (37.2±0.1) cm | ha= (36.9±0.1) cm |
| hc= (9.8±0.1) cm | hc= (13±0.1) cm | hc= (9.7±0.1) cm |
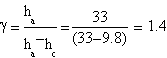 |
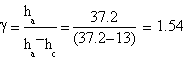 |
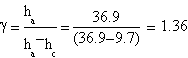 |
Per associare a γ l'errore adeguato occorre fare la deviazione standard:
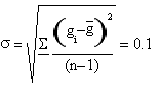
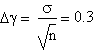
Il risultato che abbiamo ottenuto é dunque γ=(1.4±0.3)
Il risultato ottenuto soddisfa le nostre aspettative poiché il valor medio di γ che abbiamo ricavato coincide con quello ipotizzato teoricamente. Tuttavia l'errore associato al risultato é necessariamente molto alto.
Infatti l'ingerenza degli errori casuali é molto elevate poiché operazioni fondamentali nell'esperienza (come la chiusura della chiavetta al termine della compressione adiabatica) dipendevano strettamente dai riflessi umani la cui precisione non é mai troppo affidabile. Inoltre anche i rilevamenti delle altezze all'interno del manometro sono soggette a possibili errori di lettura e potrebbero essere stati effettuati prima che il liquido si fosse effettivamente stabilizzato completamente.
A queste fonti di errore vanno poi aggiunte alcune considerazioni sul fatto che l'aria non sia un gas completamente biatomico, ma una miscela che, benché formata in netta prevalenza da gas biatomici, comprende anche gas mono e poliatomici; inoltre l'aria é un gas reale e non, come previsto dalla teoria, un gas perfetto.
Per gas perfetto, infatti, s'intende un gas ideale formato da molecole puntiformi, ma dotate tutte di ugual massa, non interagenti tra loro (energia potenziale=0) e dotate di una certa velocità (da cui deriva la loro energia cinetica).
Il primo sforzo per adattare la teoria dei gas perfetti a quella dei gas reali fu compiuto dal chimico olandese Van Der Waals che elaborò una correzione dell'equazione di stato, ma i dati in nostro possesso non rendevano possibile sfruttarla nell'esperienza.
Le modifiche applicate da Van Der Waals consistevano soprattutto nell'attribuire ad ogni molecola un proprio volume e nel considerare sia l'importanza della densità molare (ρ=n/V) sia le interazione elettriche esistenti tra le molecole (che, ad esempio, diminuiscono la pressione esercitata dal gas). L'equazione di stato così corretta risulta
![]()
dove a e b sono parametri relativi alle dimensioni delle molecole.
In natura le più comuni trasformazioni dei gas sono i cosiddetti processi irreversibili, cioé processi che non possono invertire il senso del loro svolgimento (che é controllato dalla variazione di entropia ΔS) e che sono così rapidi e caotici che non é possibile, pur conoscendo il loro stato iniziale e finale, determinare i valori di pressione, volume e temperatura per ciascun istante di svolgimento del processo.
Tuttavia in condizioni particolari é possibile ottenere anche processi reversibili costituiti ad esempio dalle trasformazioni isoterme, isobare, isocore e adiabatiche le cui proprietà fondamentali sono note fin dal '700 poiché sono state oggetto degli studi dei fondatori della chimica moderna.
Boyle scoprì l'inversa proporzionalità di pressione e volume nelle isoterme mentre Gay-Lussac studiò isocore e isobare identificando la diretta proporzionalità tra pressione e temperatura nelle prime e tra volume e temperatura nelle seconde.
Queste tre leggi empiriche vennero poi condensate nell'equazione di stato dei gas perfetti
PV=nRT
(dove R é la costante dei gas perfetti e n il numero di moli) di cui risultano casi particolari.
Combinando l'equazione di stato dei gas perfetti con
![]()
equazione ottenuta in via teorica studiando la pressione di un gas sulle pareti di un contenitore, si ottiene l'espressione dell'energia totale di un gas monoatomico: U=1.5 nRT
Il calore é l'energia che viene trasferita tra un sistema e il suo ambiente per raggiungere l'equilibrio termico, cioé per eliminare la differenza di temperatura esistente tra essi.
Il principio di conservazione dell'energia meccanica non contemplava la presenza di questa forma di energia per tanto quando nel '700 cominciarono i primi studi di termodinamica si rese necessario ampliarlo in modo tale da renderlo valido anche per i fenomeni termici. La variazione dell'energia totale di un sistema infatti é espressa dalla relazione
da cui si deduce che l'aumento della temperatura deve necessariamente corrispondere ad un aumento dell'energia del sistema. Se i principi della meccanica fossero sufficienti anche in termodinamica ogni aumento della temperatura dovrebbe essere frutto dell'azione di un lavoro sul sistema, ma ciò non é sempre vero. In effetti basta pensare ad una pentola appoggiata su un fornello acceso per osservare che, pur non essendo compiuto alcun lavoro su di essa, la sua temperatura cresce.
Per considerare anche questi fenomeni fisici il primo principio della termodinamica fu pertanto enunciato come
dove Q rappresenta il calore.
| ISOCORE isochor | ISOBARE isobar | ISOTERME isotherm | ADIABATICHE adiabatic |
|---|---|---|---|
| V costante | P costante | T costante | ΔQ=0 |
 |
P1V1 = P2V2 | P1V1γ = P2V2γ | |
| L=0 quindi ΔE=Q | ΔE=Q-L | ΔT=0 quindi ΔE=0 quindi Q=L | ΔE=Q-L |
I concetti di calore e temperatura sono spesso confusi nella vita comune, ma in fisica occorre distinguere chiaramente che il calore é una forma di energia, mentre la temperatura é una proprietà intrinseca dei corpi ed una loro funzione di stato (che dipende cioé solo dallo stato in cui si trova un corpo e non dal processo con cui vi é giunto) e può essere considerata come l'espressione macroscopica della velocità quadratica media delle sue molecole.
![]()
L'unità di misura del calore nel S.I. é il J, ma sono molto usate anche la caloria (cal) e la chilocaloria (Cal) che sono definite come la quantità di calore necessario per far aumentare la temperatura rispettivamente di un g e di un kg d'acqua da 14.5° C a 15.5° C.
L'assorbimento di calore da parte di un corpo produce una variazione della sua temperatura proporzionale alla sua massa, per questo motivo é apparso opportuno determinare un'espressione del calore che si riferisse ad una massa unitaria dei vari materiali.
E' stato così definito il calore specifico, cioé la quantità di calore necessaria a far aumentare di un grado la temperatura di una massa unitaria di una sostanza. Nel caso in cui l'unità considerata sia una mole di tale sostanza il calore specifico prende il nome di calore molare.
E' importante notare che, mentre il calore specifico varia sensibilmente a seconda del materiale cui si riferisce, i vari calori molari a temperature sufficientemente elevate si avvicinano tutti allo stesso valore ca 25 J/mol, che significa che ogni atomo, indipendentemente dalla sua natura, assorbe calore allo stesso modo.
La più evidente differenza tra i calori specifici spiega invece perché, ad esempio, le masse d'acqua mitighino il clima poiché, essendo caratterizzate da un Cs molto elevato si raffreddano e si riscaldano più lentamente delle altre sostanze che formano l'ambiente attorno a loro.
I gas sono caratterizzati da γ cioé dal rapporto tra il loro calore specifico a pressione costante Cp e quello a volume costante Cv. Il valore di γ é stato definito grazie alla teoria dei gas perfetti e la sua verifica sperimentale risultò quindi un esperimento cruciale per la conferma della teoria.
Cv e Cp
Nelle trasformazioni isocore, cioé a volume costante, di un gas monoatomico essendo L = 0 poiché non si verifica nessuno spostamento che provochi un aumento o una diminuzione di volume, il primo principio della termodinamica risulta ΔU=Q, da cui si ottiene che Cv=1.5nRΔT che può essere semplificato in Cv=1.5R (poiché Cv é un calore specifico molare, quindi n=1e ΔT=1).
Nelle trasformazioni isobare, a pressione costante, dal primo principio della termodinamica si ha invece che Q = ΔU + L, quindi Cp=1.5nRΔT +L.
Il lavoro termodinamico, L, può essere espresso per le isobare come
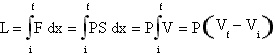
e poiché PΔV=nRΔT per l'equazione di stato dei gas perfetti, sostituendo nell'espressione del Cp si ha Cp=1.5R+R.
Conoscendo questi risultati per Cp e Cv il valore di γ per un gas monoatomico risulta
![]()
Su queste deduzioni per i gas monoatomici intervenne il fisico scozzese James Clerck Maxwell, formulando il principio di equiripartizione dell'energia. Tale principio si basa sulla ragionevolezza di aspettarsi che le molecole poliatomiche possano immagazzinare energia in forme differenti dal solo moto traslazionale (l'unico che caratterizza le molecole monoatomiche poiché sono considerabili puntiformi). Le molecole biatomiche e poliatomiche dovrebbero infatti poter immagazzinare energia anche grazie al moto rotazionale e oscillatorio.
In generale Maxwell ipotizzò che ad ogni grado di libertà del vettore velocità di una molecola fosse associato lo stesso quantitativo costante di energia. Quest'ultimo
![]()
fu ricavato dividendo per tre (i tre gradi di libertà del vettore velocità traslazionale) l'espressione dell'energia totale di un gas monoatomico ( U=1.5RT).
L'energia totale di una mole di gas risultò quindi essere in generale:
![]()
dove con f si intendono i gradi di libertà del vettore velocità.
Per le molecole biatomiche i gradi di libertà totali sono in generale 5: tre per le componenti traslazionali e soltanto due per quelle rotazionali poiché il momento di inerzia della rotazione lungo l'asse trasversale della molecola risulta praticamente nullo.
In realtà però, in accordo con la teoria quantistica che dimostra che occorre un'energia minima per innescare la rotazione (e analogamente, a temperature più alte, l'oscillazione), i gradi di libertà di una molecola biatomica a temperature molto basse sono soltanto tre (derivanti dalla traslazione) mentre oltre una certa temperatura sufficientemente elevata sono 6 poiché tra le molecole comincia a svilupparsi il moto oscillatorio. (Immaginando di aumentare ulteriormente la temperatura si raggiungerebbe il limiti oltre il quale l'oscillazione delle molecole sarebbe talmente elevata da disgregare la molecola in atomi distinti).
Tuttavia supponendo di rimanere a medie temperature per un gas biatomico risulta:
![]()
Per un gas poliatomico invece i gradi di libertà totali sono 6 poiché oltre alle tre componenti traslazionali anche tutte le tre rotazionali sono significative.
Per questi motivi per un gas poliatomico risulta:
![]()
Le trasformazioni che avvengono senza scambio di calore con l'esterno sono dette adiabatiche (dal greco a - non diabaino - passare attraverso).
Per tali reazioni é verificata l'equazione di Poisson
P1V1γ = P2V2γ
che afferma l'inversa proporzionalità tra la P a cui avviene la reazione ed il Vγ occupato.
L'equazione di Poisson deriva dallo sviluppo matematico dell'equazione di stato dei gas perfetti e del primo principio della termodinamica per le adiabatiche in forma differenziale.
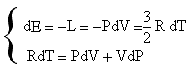
ricavando dalla prima dT e sostituendola nella seconda si ha
![]()
dove 5/3 è l'espressione di γ per i gas biatomici.
Dividendo entrambi i membri per PV si ha
![]()
che integrando diventa
![]()
![]()
![]()
poichè un logaritmo è costante quando lo è il suo argomento.
Con la rivoluzione scientifica si apre un profonda riflessione sul metodo che deve essere proprio dello studio scientifico, riconoscendo che solo concordando sul procedimento tutti potessero condividere i risultati ottenuti. Tale riflessione ha, ad esempio, portato all'introduzione dell'esperimento, cioè di un'operazione di verifica pratica creata appositamente (quindi tenendo conto di tutti gli accorgimenti eventualmente necessari) per controllare la veridicità di un'ipotesi.
Al dibattito sul metodo hanno partecipano gli intellettuali di tutta Europa tra i quali Bacon, che scrisse il "Novum Organum" nel quale teorizzò la necessità di dividere il processo conoscitivo in due fasi, la prima delle quali, pars destruens, tesa a liberare la mente dagli idola cioè dai pregiudizi che la offuscano e la seconda, pars construens, organizzata in modo analitico e tale da permettere la conoscenza dei fenomeni specifici attraverso operazioni logiche quali l'induzione e la deduzione affiancate dall'utilizzo di esperimenti.
Al dibattito contribuì poi Descartes, che compose il "Discorso sul metodo" (pubblicato nel 1637 in Olanda dove si era trasferito per godere di libertà politica e religiosa che nel resto d'Europa era fortemente limitata dalla Controriforma o dai regimi assolutistici) nel quale non solo teorizzò le fasi del metodo (analisi, sintesi e revisione, tutte basate sul principio di evidenza) introducendo l'uso sistematico del dubbio come strumento per arrivare alla conoscenza, ma avviò anche una ricerca sui fondamenti del metodo e sulla legittima possibilità di estenderlo anche ad altre discipline.
Anche Galileo offrì il suo apporto alla riflessione, benchè infatti non si occupò mai sistematicamente dell'argomento,è possibile rintracciare tra le sue diverse opere indicazioni significative sulla sua posizione al riguardo. Nella lettere a madama Cristina di Lorena, per esempio, affermò la possibilità di procedere nello studio di un fenomeno partendo o da sensate esperienze o da necessarie dimostrazioni. Nel primo caso si dovevano sviluppare per induzione le esperienze condotte dai sensi arrivando a formulare una legge generale da cui si potessero dedurre casi particolari da sottoporre a verifica sperimentale; nel secondo invece si partiva da ipotesi da sottoporre ad esperimenti.
Galileo inoltre diede grandissima importanza alla matematica di cui però non enfatizzò soltanto la possibilità di quantificare e dunque di rendere misurabili tutte le grandezze, come riconoscevano anche i suoi contemporanei, o l'essere "
il linguaggio con cui è scritto l'universo"
, idea già presente nelle dottrine pitagoriche e platoniche, ma di cui riconobbe anche un vero e proprio ruolo propulsivo, capace cioè di suggerire nuove ipotesi (da sottoporre poi a verifica per diventare legge) sviluppando teoricamente risultati già ottenuti.
Il processo che abbiamo usato per ricavare l'equazione di Poisson conferma questa concezione della matematica poichè esso, partendo da due equazioni e sviluppandole con il solo uso della matematica pura,è arrivato a mostrare una proporzionalità tra le grandezze interessate da una trasformazione adiabatica. Da questo punto di vista l'esperienza di Clément Desormes può essere ritenuta l'esperimento necessario a rendere verificata l'ipotesi cui siamo giunti proprio grazie al ruolo creativo che Galileo riconobbe alla matematica.
L'esperienza inoltre può essere considerata un esperimento cruciale per il controllo della teoria cinetica dei gas perfetti poichè permette di valutare γ di un gas considerato biatomico. Sapendo che il valore di γ (rapporto tra Cp e Cv) è, per un gas biatomico, fissato dalla teoria 1.4, se il risultato ottenuto con l'esperimento vi si avvicina la teoria stessa risulta verificata.
"GAS: denominazione generica di qualsiasi sostanza che a pressione e temperature ordinarie si trova allo stato aeriforme"Garzanti 1997
Per avere una definizione almeno orientativa sui gas é oggi sufficiente sfogliare un comune dizionario, ma storicamente uno studio scientifico (nel senso moderno del termine) sull'argomento é stato fortemente ritardato a causa della loro apparente mancanza di peso, inafferrabilità e invisibilità. Nell'antichità infatti le loro caratteristiche ne suggerirono una natura divina o simile all'anima. Anassimene da Mileto, attivo nel VI° sec. a.C. identificò nell'aria, il gas più comune, l'arché cioé l'elemento originale che ha dato origine a tutti gli enti e che come un'anima ed un soffio (pneuma) imprime negli animali la vita, il movimento ed il pensiero, in virtù della sua intelligenza, infinità e incessante movimento.
Nel V sec. a.C. Empedocle di Agrigento rese l'aria uno delle quattro radici (insieme a fuoco, acqua e terra) che, animate da due forze divine (filia e meicos), si aggregavano e separavano secondo le fasi di un ordinato ciclo cosmico dando origine alla vita e alla morte di tutti gli enti, la cui eterogeneità venne per la prima volta giustificata sostenendo che tutte le cose fossero composte dagli stessi quattro elementi base combinati però in proporzioni differenti. (Su questo presupposto si basarono anche le dottrine gnoseologiche e sulla nutrizione elaborate dal filosofo).
La teoria delle quattro radici venne poi ripresa da Aristotele (e conseguentemente assorbita dogmaticamente dal Medioevo durante il quale lo Stagirita fu elevato al ruolo di auctoritas) da cui venne però sostanzialmente modificata. Innanzi tutto egli concepì la differenza tra gli elementi solo come una diversa combinazione di qualità della materia primigenia e in secondo luogo divise le radici tra attive, fuoco e aria (cui corrispondevano rispettivamente caldo-asciutto e caldo-umido) e passive, acqua e terra (caratterizzate dalle qualità freddo-umido e freddo-secco). -Le caratteristiche che Aristotele attribuì all'aria sono in realtà più proprie del vapore, ma i tempi non erano ancora maturi per tale distinzione.
In seguito importanti osservazioni sui gas (e sul vapore) furono condotte in ambito ellenistico ad Alessandria, nuovo centro della cultura in seguito alla caduta delle polis e al conseguente declino di Atene. La città era stata dotata della più grande biblioteca dell'epoca e di un museo destinato anche all'insegnamento e il mecenatismo dei Tolomei era riuscito a raccogliere lì studiosi da tutto il mondo. Nella moltitudine di dottrine che si svilupparono ad Alessandria trovarono posto sia i primi fondamenti dell'alchimia (favorita anche dalla cooperazione tra filosofi e artigiani), sia teorie scientifiche che sembrano anticipare di secoli la rivoluzione del 500/600. Tra queste vi furono quelle di Erone (62 / 140 d.C. circa) i cui risultati nello studio sulla compressione dei gas verrà pienamente assimilato nella teoria cinetica sviluppatasi solo nel '700 vanificando la precocità delle intuizioni di Erone che all'epoca vennero abbandonate non trovando immediatamente riscontro pratico e non suscitando dunque particolare interesse.
Nel '300 durante le pestilenze, se negli ambienti colti rimase il concetto aristotelico dell'aria, tra le masse che del gas non possedevano un'idea troppo precisa, si diffuse l'idea che essa altro non fosse che una pericolosa fonte di contagio. In realtà solo nel '900, con l'utilizzo delle armi chimiche e nucleari l'aria si renderà in effetti portatrice di morte.
L'origine della parola gas si ha nel periodo della rivoluzione scientifica ad opera dell'olandese Jan Baptist van Helmont (1577 / 1644), uno dei primi "chimici di professione" per sua stessa definizione, che, in seguito a numerosi studi sulla combustione, coniò questa nuova parola a partire dalla pronuncia fiamminga di geist (caos).
Il concetto di geist al quale van Helmont si riferì é quello nato nell'antica Grecia (e ripreso da Paracelso pochi decenni prima) che definiva il caos come l'elemento originario in cui era accorpata tutta la materia che solo in un secondo momento per sublimazione s'era divisa da esso e moltiplicata nei vari enti. (Paracelso recuperò quest'immagine per affermare l'idea che l'universo fosse indagabile grazie alla chimica e non per via matematica come sosteneva invece la maggioranza degli intellettuali che presero parte alla rivoluzione scientifica e a questo proposito i suoi seguaci crearono anche la figura di un Dio grandioso alchimista, che nell'atto della creazione aveva separato dal caos originario tutte le cose del mondo. )
Sempre nel periodo della rivoluzione scientifica gli studi sulla pressione, condotti da Galileo, Torricelli e Stevin, servirono a chiarire con più precisione cosa s'intenda per gas.
Galileo in particolare fu il primo a proporre un esperimento che pesasse l'aria, dimostrando che l'assenza di peso dei gas fosse solo apparente. Per dimostrarlo utilizzò una bilancia ad alta precisione su cui, dopo aver equilibrato il peso di un pallone pieno d'aria con tanti granelli di sabbia mostrò che, lasciata sfiatare il gas, l'equilibrio della bilancia veniva rotto.
Il proseguimento degli studi sui gas ci permette oggi di sapere che l'aria é una miscela di gas formata al 78% da azoto (N2), al 21% da ossigeno (O2) e all' 1% da altri gas come l'argo e l'anidride carbonica. (La predominanza dei gas biatomici (N2, O2)nella composizione dell'aria é talmente larga da rendere la miscela aderente, con buona approssimazione, alle leggi formulate nella teoria cinetica dei gas biatomici. )
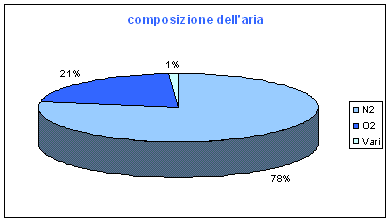
Le percentuali di questi elementi variano a seconda della maggior o minor presenza in aria di vapore acqueo, pulviscolo atmosferico (insieme delle polveri e delle sabbie portate dal vento, dei pollini, dei sali minerali, dei residui di combustione formati dagli incendi naturali e delle ceneri provenienti da eruzioni vulcaniche) e di sostanze immesse dall'uomo che hanno spesso effetti inquinanti.
Le sostanze gassose liberate, infatti, interagendo con gli altri componenti dell'atmosfera alterano gli equilibri dell'ecosistema provocando danni a tutti gli organismi viventi e minacciando anche la salute umana. In generale se gli inquinanti immessi sono poco reattivi essi riescono a salire fino alla stratosfera dove, in contatto con l'ozono, lo distruggono assottigliandone lo strato; se invece tendono a reagire con facilità possono subire trasformazioni chimiche e precipitare immediatamente a terra oppure essere incorporate in particelle solide o disciogliersi nelle gocce d'acqua e cadere al suolo in un secondo momento attraverso processi definiti rispettivamente deposizione secca e deposizione umida, più nota come fenomeno delle piogge acide.