(note a cura di Roberto Bigoni)
Nello studio della teoria cinetica dei gas perfetti si è dedotta la Legge di Poisson per le trasformazioni adiabatiche che afferma che in una trasformazione adiabatica da uno stato iniziale A ad uno stato finale B vale la relazione
![]()
dove P e V sono la pressione e il volume e γ è il rapporto tra calore specifico a pressione costante (cp) e il calore specifico a volume costante (cv).
La teoria cinetica dei gas perfetti deduce anche precisi valori per γ
Per sottoporre la teoria cinetica dei gas perfetti ad un
controllo cruciale si potrebbe cercare di misurare
sperimentalmente il valore di γ per un gas reale a molecole
monoatomiche (elio, neon,...), biatomiche (ossigeno, azoto,
idrogeno...) o poliatomiche (anidride carbonica, ammoniaca,
metano...) per vedere se i risultati non disconfermino le
previsioni teoriche.
Non disponendo di attrezzature specializzate, ci si può limitare
a tentare di misurare il γ dell’aria atmosferica, con
l’avvertenza di ricordare che essa non è un gas omogeneo ma
è una miscela di azoto e ossigeno con tracce significative di
altri gas.
Data comunque la prevalenza in essa di molecole biatomiche di
azoto e ossigeno, il valore da ottenere non si dovrebbe
discostare troppo da 1.4.
Per riuscire a misurare il γ di un gas bisogna ottenere una sua espressione in funzione di grandezze sperimentalmente misurabili. Tali grandezze non possono essere cp e cv che non sono facilmente osservabili, ma altre grandezze più facilmente accessibili, come, ad esempio, le pressioni.
Questa via viene seguita nel metodo messo a punto da Clément e Desormes.
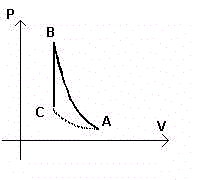
Al gas contenuto in un recipiente si fa subire una compressione adiabatica che dallo stato A(PA,VA,TA) lo porta nello stato B(PB,VB,TB). La temperatura TB sarà maggiore di TA.
Dalla legge di Poisson (1) si ricava
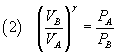
Dalla legge generale dei gas perfetti
![]()
si ricavano
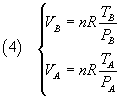
Dividendo le (4) membro a membro si ottiene
![]()
Sostituendo nella (2) il secondo membro della (5)
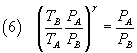
Se ora dallo stato B si passa allo stato C(PC,VC,TA), dove la temperatura ritorna a TA con un raffreddamento isocoro, per la legge di Gay-Lussac si ha
![]()
cioè
![]()
E, sostituendo nella (6) e quindi semplificando, si ottiene
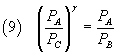
Per risolvere questa equazione rispetto a γ si calcola il logaritmo di entrambi i membri ottenendo
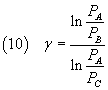
Si riesce così ad esprimere γ in funzione delle pressioni dei tre stati ai quali è stato portato il gas: misurando tali pressioni si può quindi calcolare γ.
Per misurare le pressioni ci si può servire di un barometro a liquido di densità ρ.
Se si organizza la misura in modo che PB coincida con la pressione atmosferica ambiente
P0 (~ 1 Atmosfera), le pressioni PA e PC possono essere espresse
con la legge di Stevin
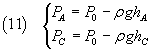
Il numeratore della (10) può essere scritto
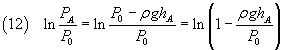
Dato che, per piccoli valori di x , ln(1-x) ~ -x, il numeratore della (10) può essere approssimato in
![]()
Il denominatore della (10) può essere scritto
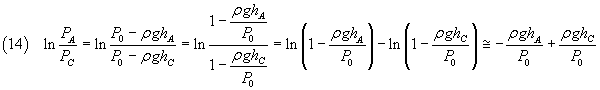
In definitiva la (10) è ben approssimata dalla
![]()
Per potere utilizzare la (15) per la misura del γ dell’aria è necessario far compiere ad una massa d’aria, inizialmente nello stato A(PA,VA,TA) una trasformazione adiabatica che la porti nello stato B(PO,VB,TB) e quindi una trasformazione isocora che la porti nello stato C(PC,VC,TA) potendo, nei tre stati, misurare le pressioni con le altezze di un liquido barometrico.
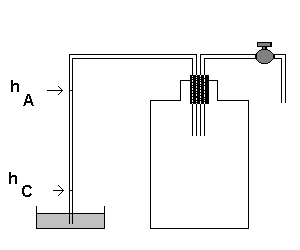
Un modo per realizzare questa situazione sperimentale è il seguente.
Si hanno quindi le misure hA e hC necessarie per ricavare γ dalla (15).
Poiché la tecnica di misura fa affidamento sull'abilità manuale dello sperimentatore, le misure saranno inevitabilmente soggette ad errori casuali: per una buona misura e per una buona valutazione dell'incertezza su di essa bisognerà replicare più volte la misura stessa ed associarle come incertezza il triplo della deviazione standard.
ultimo aggiornamento: Giungo 2020